利用細胞的特性[尺寸、密度、電特性、表面(抗原)性質,光散射特性等等]可以用各種方法分離和純化細胞。離心分離是利用不同尺寸和密度的細胞在離心場中沉降行為的不同,從組織勻漿或血液中分離純化的技術。用離心技術分離和純化細胞主要依賴的方法是差分離心、速率-區帶密度梯度離心、等密度離心和利用特殊轉頭的細胞浮選離心。
下面的表格概括了細胞離心分離純化主要方法:(文獻1)
| 分離依據 | 方法名稱 | 離心加速度 | 梯度形狀 | 使用工具 | 局限性 | 優點 |
| 細胞密度 (ρ) | 平衡 等密 度離 心 | 比較高 (100 ~ 30,000 × g) | 連續或不連續 梯度 | 甩平轉頭,固定 角轉頭, 區帶轉 頭 | 離心力較 大,等密度 純樣品區帶 可能重疊 | 細胞易聚合;應用面較 面較廣 |
| 沉降速度(細胞平 均直徑d 密度ρ) | 差分離心 | 1 ~ 300 ×g | 無梯度 | 角式為主 | 低分辨率 | 快速,簡易 |
| 單位重力 加速 度沉 降 | 1g | 連續梯度 | 特殊分離容器 | 容量50 × 106個細胞, 特殊裝備, 時間長 | 簡單,價廉 | |
| 速率 -區 帶離 心 | 20 ~ 1 , 000×g | 連續梯度,線性 或等速度沉降 梯度,ρ梯度介 質≤ρ細胞 | 甩平轉頭或區帶 轉頭 | 中等分辨 率,容量范 圍寬 | 大容量用區帶轉 頭,小容量用甩平 轉頭,后者操作簡 單 | |
| 離心 浮選 | 100 ~ 3,000×g | 無梯度 | 細胞浮選轉頭 ( 日立或 Beckman) | 裝置費用高 | 快速,高分辨率, 處理量較大 |
細胞離心分離純化概述:
1. 利用細胞密度差異進行分離:
一般的做法是在連續或者不連續(階梯)梯度液上表面鋪樣品,梯度的范圍應該包含被分離的細胞的密度,經過離心達到平衡后各種細胞沉降在它們各自的等密度區形成比較純的單一細胞分布區帶。這種等密度離心法可以用于制備或分析用途。用于制備時要注意在勻漿中可能有多種不同密度的細胞,如果它們的密度差很小,離心后會造成各個細胞區帶之間的重疊。因此要優先考慮利用細長離心管,合適的密度范圍;較少的加樣量(離心管容量的2%~3%);或者用同一個甩平轉頭進行2~3 次分離;每一次分離的zui大、zui小密度梯度差減少(即減少梯度斜率;分別用凸指數及凹指數梯度曲線進行分離;用不同的等滲液改變不同細胞在梯度介質中的浮密度(文獻2)。
在離心管中細胞勻漿可以鋪在預形成的連續或不連續梯度液的上部或鋪在梯度液的中間某一位置,后者可以在離心過程中讓部分密度較小的細胞上浮,讓一些密度較大的細胞沉降,減少了沉降距離,從而縮短了離心時間。
不連續的階梯梯度常用于血細胞分離或肝細胞分離,作血細胞分離時梯度材料可選擇Ficoll-metizoate,肝細胞分離可選擇Nycodenz 或metrizamide ( 文獻3)。
2. 根據不同細胞的沉降速度差異進行分離:
由于細胞在梯度介質中的沉降速度和細胞直徑的平方成正比,和細胞與介質密度差一次方成正比(參考講座文獻2-“實驗離心技術的基本計算”)所以影響沉降速度的首要參數是細胞尺寸,其次才是密度。
沉降速度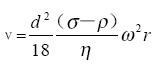 ,ν的單位是(厘米/秒)
,ν的單位是(厘米/秒)
公式中 d 為細胞直徑(cm)
σ為細胞密度(克/cm3) η為介質粘性系數
ρ為梯度介質密度(克/cm3) ω為轉頭旋轉角速度
r 為細胞所在位置與旋轉中心的距離(cm)
ⅰ. 差分離心:
在不存在密度梯度條件下分離細胞是這種方法的主要特點,差分離心可以是利用地球重力(1g),也可以是利用低速離心分離組織勻漿。在重力或離心力作用下一些比較大的細胞沉降速度較快,當它們已變成沉淀時,大部分比較小的的細胞由于沉降速度慢而仍留在上清液中。很明顯在大的細胞變成沉淀時一部分接近離心管底的較小細胞在離心力也已變成沉淀,*次離心可以使zui大顆粒細胞全部沉淀但沉淀中少量的較小細胞降低了分辨率和純度。我們可以用*次離心同樣轉速和時間將*次沉淀稀釋后再離心(每次都要用同樣的緩沖液稀釋)(這叫在離心機中“洗”),重復數次可以得到較純的大顆粒沉淀。各次上清液合并以更高轉速離心,重復以上過程數次,就可以得到各種較純的不同大小的顆粒的沉淀。如果利用某些特殊梯度材料(如dextran percoll 可以用 小的離心次數得到較好的結果。(文獻4)。
ⅱ. 依賴重力加速度沉降:
不用離心機,將細胞懸液鋪在預形成密度梯度上表面,在重力作用下細胞沉降。一般設計的密度梯度采用較小的密度變化范圍,其zui大密度小于密度zui大的細胞密度。不同密度的細胞以很慢的速度按不同層次沉降。在zui大密度細胞達到底部之前進行分部收集。(收集的方法參照“離心技術講座”文章3a)
ⅲ. 利用速率-區帶密度梯度離心法分離細胞:
在本質上與重力沉降是一樣的,但是利用離心場來減少分離的時間。小容量樣品用甩平轉頭,大容量樣品用區帶轉頭,對于較少數量的細胞(106 ~108),并且不同細胞的沉降速度有較大差異,用甩平轉頭離心分離可以得到很滿意的結果。對于較大數量的細胞(>109)可以考慮利用區帶轉頭。區帶轉頭操作是離心技術中比較復什的分離工藝,需要較熟練的操作人員,細心的工作才能得到成功。由于在區帶轉頭中離心分離不存在用離心管分離時產生的壁部效應(Wall effect)參考加離心技術講座文獻3),可以一次離心收獲大量比較純的細胞。
曾有人在甩平轉頭的吊桶中加特殊的適配器(套管)來分離純化少量的細胞(>5 ×107),提高了分離的純度(文獻5)。
如果不同細胞間尺寸差別不大,在離心場中沉降速度差別不大;或者需要制備大量的細胞用這個方法就不太合適。
iv. 離心浮選
利用一個特別的錐形轉頭,錐頭方向與離心力方向相同,樣品從錐頭進入,利用離心力在圓錐形離心管中對細胞產生的逆流效應,可以有效地分離各種細胞(如各種培養細胞,酵母細胞,各種血細胞,受精卵等等)離心浮選轉頭一般配備在低速或高速低溫離心機中(如Hitachi 的R5E 離心浮選裝置,Beckman 的JE-6B 離心浮選系統)由于樣品是從圓錐頭部壓入,每種細胞都受到離心力和由于錐度形成的流速梯度產生的反向力,不同形狀、尺寸、不同密度的細胞在錐形離心室中不同位置達到力的平衡從而形成不同種類細胞的區帶,按順序從錐室大頭排出。
這個方法的特點是
l 不需要制備密度梯度;
l 可以分離107 ~109 個細胞;
l zui使用于分離平均尺寸為2μm~50μm 的細胞;
l 由于錐形離心管用透明材料制成,在離心室門蓋上可以安裝透明窗用于觀察分離情況并可以裝置攝像機通過屏幕觀察分離過程;
l 加樣泵有較大的流量1~120 毫升/分,可以在很短時間內用較低的轉速(zui高
不超過5,000rpm)成功分離各種細胞;
l 不損傷細胞;
l 很高的分辨率;
l 設備投資很高,操作者需培訓積累操作經驗。因此應用受到很大限制。
3. 用于細胞分離的密度梯度
在講座3 中已較詳盡地敘述了密度梯度材料,梯度形狀,梯度離心等問題,對于細
胞離心分離,對密度梯度材料還有一些特別重要的提示:
l 對細胞無毒性;
l 可以配制等滲液;
l 不會滲入細胞內部;
l 離心后作分部收集,易從收集液中除去分離介質(如透析);
l 較低的粘性系數。
用于細胞分離的梯度材料是:Percoll, Nycodenz, Ficoll, metrizamide 和小牛血清白蛋白。它們的性質已在講座文獻的(3),(3)a,(18)中已說明。
細胞分離常用的梯度可以是線性的,非線性的(凸指數或凹指數)連續的或不連續的,梯度制備方法參考講座文獻3(a)。
需要指出的是細胞離心配置的梯度液必須是等滲的,沿整個離心管長度方向滲透壓變化要小于10%,也就是說細胞在沉降過程中收縮和膨脹都非常小,它們的基本性狀和離心分離前基本一致。梯度材料研制和生產廠對于配制各種等滲液都提供了詳細資料。(講座文獻18)
4. 細胞離心分離過程中常常遇到的一些問題
i. 細胞聚集:
細胞聚集后在離心過程中的沉降行為與單個細胞*不同,因此出現細胞聚集會影響分離純度。避免的方法是添加一些防止粘結的成分如小牛血清白蛋白,脫氧核糖核酸酶(D Nase ,防止膠結)、蛋白酶(protease )、EDTA 等;(參考文獻6)
關于離心分離溫度,有些論文設在4℃離心分離細胞效果很好,也有人認為初步分離時溫度應保持在20℃以上。(文獻7)
ii. 在梯度液中細胞過載:
在密度梯度離心中,每種細胞的數量都不能超過對應于它的密度的梯度液的容量, 也就是每種細胞在梯度液中所占有的梯度層的厚度是受限制的,過分厚的純樣品區帶會與別的細胞的純樣品區帶相重疊;這是問題的一方面。另一方面,雖然垂直管轉頭在高速離心時,它的離心管縱切面可以容納更多的樣品分子(與甩平轉頭的離心管橫剖面相比較),但在離心完成、梯度從垂直方向轉換到水平方向后,每個純樣品所占據的離心管中心軸上的寬度很大。如果初始樣品中所含的細胞品種很多,純化后也會造成純樣品帶的重疊。關于這個問題沒有的數學計算,全靠用戶在實驗中逐漸積累經驗。這涉及待分離樣品中細胞的濃度,和梯度離心時的加樣量(2%~5%離心管容量)以及梯度的形狀(梯度曲線的斜率,連續梯度或者階梯梯度)等等。
iii. 壁部效應:
在角式轉頭中沿離心力方向沉降的細胞接近離心管壁部時,與在離心力分力作用下沿管壁下滑的細胞碰撞,造成在角式轉頭離心管近外壁部形成了一個“壁部效應區”,這個壁部效應區從離心管上部到下部逐漸加寬。由于壁部效應,可能會造成部分細胞的聚集而影響分離純度,也可能有一小部分細胞由于碰撞而受損。這種影響在用固定角式轉頭作等密度離心時尤為顯著。所以細胞離心分離除浮選轉頭外一般小容量選擇甩平轉頭,大容量選擇區帶轉頭。
iv. 旋渦效應:
在加速或減速過程中在離心管中產生的小旋渦會影響梯度的完整,在減速過程中還會影響已被分離的純樣品帶的寬度,轉速500rpm~1000rpm 之間往往在復合向心力、也就是Coriolis 力的作用下在離心管中會產生渦旋,渦旋在下列情況下可以減少:
l 增加回轉半徑;
l 慢加速和慢減速(根據不同轉頭,不同容量,不同離心方法可以多檔控制的加、減速速率);
l 縮小離心管直徑(∮10mm 以下,這在大多數情況下不現實);
l 使用一些抗旋渦的緩沖液(文獻5);
l 應用有較陡斜率的密度梯度。
l 縮小離心管直徑(∮10mm 以下,這在大多數情況下不現實);
l 使用一些抗旋渦的緩沖液(文獻5);
l 應用有較陡斜率的密度梯度。
v. 液滴效應:
在預形成密度梯度液上表面加待分離的細胞樣品,如果不馬上離心,就會有很少的液滴滴入梯度層。這個現象在加樣后幾分鐘內會發生,其結果是在樣品與梯度液的界面上出現層間擴散(文獻8)而影響分離效果,減少這種影響的方法是
l 降低樣品濃度;
l 提高梯度液的初始斜率;
l 在鋪完樣品后立即放入轉頭并開始離心分離。
vi. 離心力的選擇:
離心力選擇不當會影響細胞活力改變、細胞的內部構造、影響細胞的裂介和復制。這種影響常出現在:
l 長時間的離心分離過程;
l 轉頭的快加速;
l 過大的離心力產生了較大的流體靜壓;
l 應用較高轉速的等密度離心法。
如果我們選用較低的轉速,粘度較小的梯度材料(本講座文獻18);利用細胞浮選轉頭等都可以減少這種影響。
vii. 滲透效應:
很多細胞特別是哺乳動物細胞沒有堅固的細胞壁,周圍的介質很容易滲透到細胞內部或者細胞內液體反向滲透到周圍介質中而引起細胞的膨脹和收縮,從而改變離心過程中細胞的沉降(或上浮)特性。因此配制等滲的梯度液是必要的(講座文獻18)
(二)實用細胞離心分離方法舉例
(1) 血細胞純化:
血細胞由多種類型的但細胞懸液組成,每種細胞都有它們自身的特性和功能并廣泛被用于醫學臨床和診斷。多年來研究人員對血細胞分離純化作了大量工作,實驗室研究和血液成分分離都已廣泛使用各種離心設備,如用于醫學臨床分析、診斷的全自動血細胞洗滌離心機(Hitachi MC-450,24 管,Sorvall CW-2,12 管),用于大量血液(標準200ml,300ml,400ml,500ml 三聯或四聯血袋)成分分離用的大容量低速、低溫離心機(參考技術講座文獻1)等等。下面我們將以實驗室研究為主線,舉例說明各種血細胞分離純化方法。
由B∮yum 研發并在多年來被普遍應用的血細胞純化方法是用梯度材料Na-metrizaate 與Ficoll 的混合液作密度梯度離心,把血球中的紅血球,多形核細胞、淋巴細胞、單核細胞、血小板分離純化。這種溶液有不同的商品名稱如Lymphoprep(Nycomed Pharma 公司)、Ficoll -pague (pharmacia-Biosystems 公司)等,都可以作這一用途。(文獻9)
下面的例子是在室溫下用低速離心機作血細胞分離的實驗。
例1.人血中單核(白)細胞的純化
| i. | 用抗凝血劑處理血樣,常用抗凝劑為0.32%檸檬酸鈉。 |
| ii. | 用等容積的生理鹽水稀釋血樣。 |
| iii. | 在10ml~15ml 離心管中先注入3ml metrizoate-Ficoll 分離液,在其上鋪6ml 已稀釋 |
| | 血樣。 |
| iv. | 用甩平轉頭600g(1,800~3,000ropm,臺式機)×20 分,20℃。( 不要在4—5℃低 |
| | 溫離心,否則分離效果將很差。 |
| v. | 離心后用巴氏移液吸管從血漿與分離液界面中間吸出血細胞層,其中含有單核(白) |
| | 細胞和部分血小板。 |
| vi. | 加入幾毫升生理鹽水,降低收集的血細胞濃度。 |
| vii. | 同一離心轉頭,同一離心管250g(1200rpm 左右)×5 分鐘20℃。可以用同一工 |
| | 藝在離心機中洗幾次。 |
| viii. | 收集沉淀在生理鹽水中保存。 |
例2. 從人血中分離紅細胞,單核(白)細胞,中性(白)細胞
i. 新鮮人血(3~5)ml 用抗凝劑處理。
ii. 15ml 離心管中先注入5ml 分離液Polymorphprep(Nycomed Pharma A/S 公司產品), 然后鋪上用抗血凝劑處理過的人全血5ml 。
iii. 臺式低速離心機,甩平轉頭,450g(1500~1600rpm)×35 分鐘,18℃~23℃。
iv. 分離結果:離心管上部近40%液柱為血漿,接下來一薄層為單核細胞再下面間隔了少量分離液后又是一薄層中性(白)細胞,再往下近30%液柱為分離液,紅細胞在底部(沉淀)。
注意:溫度過高,或離心力過大,或離心時間過長都可能使中性(白)細胞沉淀。
表:用于人血細胞分離純化的各種商品分離液(摘自文獻1)
| 名稱 | 成分 | 用途 | 生產商 |
| Lymphoprep | 9.6%Na-metrizoate, 5.6% Ficoll | 單核細胞分離 | Nycomed-pharma |
| Ficoll-page | 9.6 Na-diatrizoate 5.6% Ficoll | 單核細胞分離 | Pharmacia-Biosy-st ems |
| Nycoprep 1.077 | 14.1% Nycodenz 0.44% Nacl | 單核細胞分離 | Nycomed-pharma |
| Nycoprep mixer | 19.0% Nycodenz 0.2% Nacl | 單核細胞分離 | Nycomed-pharma |
| Nycoprep 1.068 | 13.0% Nycodenz 0.58% Nacl | 單核(白)細胞淋巴細胞分離 | Nycomed-pharma |
| Nycoprep 1.063 | 12.0% Nycodenz 0.58% Nacl | 血小板分離 | Nycomed-pharma |
| Mono-poly Resolving medium | 15.5% Na-diatrizoate 8.18% Ficoll | 多形核細胞分離 | Flow-Laboratories |
| Polymorphprep | 13.8% Na-metrizoate 8.0% Dextran 500 | 單核細胞中性白細胞紅細胞分離 | Nycomed-pharma |
(2) 用等密度離心法分離肝細胞:
肝細胞的離心分離在整個細胞純化工藝中具有典型性。以鼠肝為例,每克鼠肝中有1.1 ×108 個肝主質細胞(Parenchymal);107 個肝星形細胞(Kupffer cell),2×107 個內皮細胞和1.6×107 個儲脂細胞。
對這些肝細胞的分離純化,研究人員多年來做了大量實驗研究,下面概述一些典型離心分離實例:
例3:肝細胞的連續密度梯度分離
離心分離工藝需要下列基本設備,化學品和溶劑:
l 帶有電磁攪拌器或旋翼攪拌器的密度梯度制備儀;
l 蠕動泵,硅膠管(內徑1~1.5mm,外徑3mm 左右),有些商品的自動梯度制備和收集(如日立DGF-U)本身就帶有蠕動泵,硅膠管;
l 帶有恒溫裝置的阿貝折射儀;
l 帶水平轉頭的低溫,低速離心機(臺式、落地均可);
l 離心管,是15ml corex 玻璃離心管;
l 平衡鹽溶液GBSS,配置如下:Nacl(8,000mg/l);KCL(370mg/l);Mg SO4·7H2O
(70mg/l);NaH2PO4·2H2O(150mg/l);Cacl2·2H2O(220mg/l);NaHCO3(227mg/l);
KH2PO4(30mg/l);Mgcl2·6H2O(210mg/l);葡萄糖(1,000mg/l);調節到PH7.4;
滲透壓275~285mOsm,消毒過濾后儲存于4℃;
l 28.7%(W/V)Nycodenz 或者30%(W/V)metrizamide 在無Nacl GBSS 中,滲透壓285 mOsm, PH7.4;
l 竇狀肝細胞(制備方法參見文獻1,P313 或其他文獻);
l 0.5%(W/V)臺酚藍(trypan blue )在生理鹽水中;
l 制備過氧化物酶染色需要的條件(參見文獻10)
l 0.5%(W/V)臺酚藍(trypan blue )在生理鹽水中;
l 制備過氧化物酶染色需要的條件(參見文獻10)
分離方法:
i. 從一個鼠肝中制備(2~3)×106 個肝竇狀細胞;
ii. 細胞在15ml GBSS 中洗三次;
iii. 低速離心300g(1200~1300rpm)×5 分鐘,室溫;
iv. 沉淀用6ml GBSS 制成懸液;
v. 制備梯度液和離心分離:
l 將30%(W/V)metrizamide 或28.7%(W/V)Nycodenz(是Nycodenz,因為它可 以高溫滅菌)分別用GBSS 稀釋到20%和19.1%-溶液A
l 用溶液A(metrizamide)(3.1 倍體積)稀釋iv 細胞懸液,成為8%(W/V)metrizamide 梯度液或用溶液A (Nycodenz)(5.4 倍體積)稀釋iv 懸液,成為7.7%(W/V)Nycodenz 梯度液
l 制備8%~20%metrizamide 或7.7%~19.1%Nycodenz 連續線性梯度(用本講座中所用各種方法或利用Hitachi DGF-U)
l 用甩平轉頭,低溫,低速離心機,2,000g(約3,400~3,500rpm)×30 分鐘,4℃,
慢加速,慢減速。為了避免細胞聚集,總離心時間不要超過45 分鐘。
Vi. 結果分析
l 用DGF-U,上取法將每個離心管中溶液分部收集成25~30 管(每管0.3~0.5ml)
l 用阿貝折射儀測定各管的折射率(RI)并換算成密度
Nycodenz:密度(g/ml)=RI×3.242-3.323 metrizamide:密度(g/ml)= RI×3.453-3.601
l 用0.5% Trypan 藍溶介在生理鹽水中與分部收集的細胞液混合,被染色的細胞為無活力細胞。
l 測定細胞數量并計算有活力的細胞百分比
l 用過氧化物酶染色反應測定肝星形細胞、內皮細胞及其他細胞的分布情況。
l 過氧化物染色反應:
a:分別取每個分部收集液數滴(約5×105 各細胞)滴入2ml 細胞培養液
培養液:15mg DAB(Merck 公司產)溶于15ml 含7%(W/V)蔗糖的0.05M Tris-HCL(PH7.4 , 300 mOsm 中再加入10 30%H2O2,
注意:30 分鐘內用完。
注意:30 分鐘內用完。
b:在培養箱中37℃培養30 分鐘(也可以用恒溫水槽)
c:培養后低速離心300g×3 分鐘,去上清沉淀用200μl GBSS 稀釋
d:用血細胞計數器測定染色細胞數量:紅細胞被染后呈黑色,而肝星形細胞(Kupffer)
呈深褐色,由于它們大小不同,顏色也可分辨,在計數器上很容易鑒別。內皮細胞和
淋巴西哦保保持染色前原色。
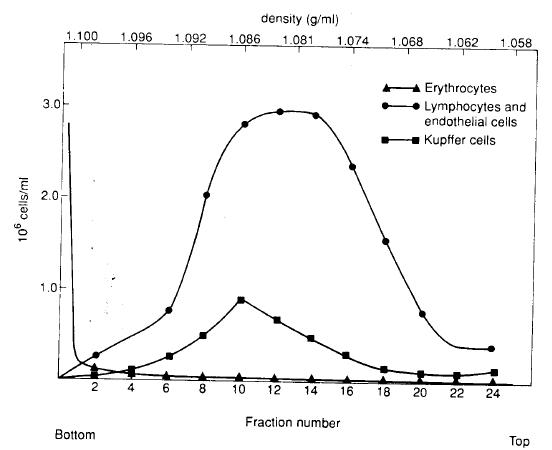
e:結果可以繪成下圖從圖可以看出:
l Kupffer 細胞在第10 管中占20%,只占總的Kupffer 細胞的一小部分。在第12~14
管中內皮細胞占50%。
l 從結果分析,用這種等密度離心法還不能*純化Kupffer 及endothelial 細胞,而
只能用于一般實驗需要。
例4:肝細胞的不連續密度梯度分離
這種方法適用于從肝竇狀細胞(Sinusoidal)中除去紅細胞和主質細胞(parenchymal),離心結果是讓紅細胞沉淀,內皮細胞(Sinusoidal)浮上。
實驗需要的基本設備和溶劑:
l 一臺帶甩平轉頭的低速、低溫離心機;
l GBSS;
l 在無NaCl的GBSS中的28.7% Nycodenz或 30% metrizamide
l 15ml塑料離心管;
l 竇狀(Sinusoidal)肝細胞;
l Trypan藍染色劑;
l 過氧化物酶染色劑,及染色需要的設備;
l 生理鹽水(0.9% NaCl);
l 固定液:2.5%戊二醛在0.1M二甲基胂酸鈉中(PH7.4)(二甲基胂酸鈉有劇毒,可用0.1M磷酸鹽代替)
l 培養液:(在通風柜或生物安全柜中配置)
9.5ml 1.0M NaCl;
11mg 1-乙酸萘脂在0.5ml乙基乙二醇-乙醚中(在氮氣中保存);
0.5ml 1.0M NaCl;
0.25ml 4% 品紅在2.0M HCL中,0.25ml 4% 硝酸鈉在純水中,共計0.5ml混合;
把以上混合液調節到PH7.4,纖維紙過濾后待用;
注意:30分鐘內用完!
離心方法:
i. 準備10ml Sinusoidal肝細胞在GBSS中懸液(1~4×108個細胞);
ii. 在懸液中加14ml28.7%(W/V)Nycodenz 或30%(W/V)metrizamide 輕輕混勻;
iii. 將以上溶液分別注入二個離心管,并在每管液面上緩鋪1-2ml GBSS;
iv. 離心:400gx15分,室溫,不用剎車,自由滑行減速至停轉;
v. 從GBSS 與梯度液之間慢慢地抽吸Sinusoidal 細胞
vi. 用例2 同樣的方法測定細胞數量和活力。
vii. 酯酶染色反應
l 數滴細胞懸液(~0.5×106 個細胞)滴入1~2ml 固定液,4℃,7 分鐘
l 700g×3 分,低速離心后,去上清,沉淀用0.9%Nacl“洗”二次(在離心機中,700g×3
分“洗”2 次)
l 取“洗”后沉淀與200μl 0.9% Nacl 作成懸液,加入等容積培養液,37℃培養染色10 分
鐘
l 用血球計數器測定染色百分比:Kupffer, endothelial 及Parenchymal 細胞染成紅色,紅
細胞及淋巴細胞不被染色,儲脂細胞微染。
l 結果可用下表表示
| 項目 | Nycodenz | metrizamide | |
| 細胞產率 | 43×106 | 44×106 | |
| 細胞活力 | 99% | 99% | |
| 細胞化學染色 | 過氧化物酶染 | 17% | 27% |
| 酯酶染 | 71% | 80% | |
| 細胞組成: | Kupffer | 16% | 26% |
| endothelial | 54% | 54% | |
| 儲脂細胞 | 10% | 1% | |
| 紅細胞 | 1% | 1% | |
| 主質細胞 | 1% | 1% | |
| 其他細胞(如淋巴細胞) | 18% | 18% | |
例5:用雙階梯不連續梯度部分純化儲脂細胞,需要的設備和化學試劑同例3。
i. 從一只成年雌鼠取肝制成Sinusoidal 細胞懸液(1~4×108 個細胞在12ml GBSS 中)
ii. 以6 倍容積的28.7%(W/V)Nycodenz 或30%(W/V)metrizamide 配以4 倍容積的
GBSS 來稀釋梯度液。取二個離心管(15ml),每管注入5ml 已稀釋的梯度液(17.2%
Nycodenz 或18%metrizamide)
iii. 將8ml 未稀釋的梯度原液與12ml 細胞懸液i 輕輕混合,混合后溶液中梯度液濃度為
11.5%Nycodenz 或12%metrizamide
iv. 每個離心管液柱上鋪5ml 已稀釋的細胞懸液與梯度液(iii 液),再在液面上鋪1~2ml
GBSS 形成雙階梯不連續密度梯度。
v. 低速離心1400g(2,700~2,800rpm)×17 分,20℃,無剎車,自由滑行至停轉。
vi. 用吸管從二個離心管的低密度界面及高密度界面上分別抽出細胞層。
vii. 用與例3 同樣的方法測定細胞產率、活力及組成并作成下表:
| 細胞名稱 | | 細胞組成 | | |
| 低密度片斷 | | 高密度片斷 | | |
| | 細胞數量(×106) | % | 細胞數量(×106) | % |
| 儲脂細胞 | 52.5 | 79.6 | 0.9 | 0.4 |
| Kupffer | 0.7 | 1.0 | 45.5 | 20.3 |
| endothelial | 10.9 | 16.6 | 129.7 | 57.9 |
| 其他細胞(如淋巴細胞) | 1.9 | 2.8 | 47.9 | 21.4 |
| 總計 | 66 | 100 | 224.0 | 100 |
(三)用沉降速度法分離細胞:
利用重力沉降(1g),或低速速率-區帶密度梯度離心(<1000×g)也可以純化各
種細胞。
下面舉一些分離實例來說明這種方法。主要方法取自參考文獻5,11,12,
用沉降速度法分離細胞舉例
下面舉一些分離實例來說明這種方法。主要方法取自參考文獻5,11,12,
用沉降速度法分離細胞舉例
| 細胞樣品 | 被分離細胞類型 | 梯度 | 離心時間 /RCF( × g) | 設備 | 結果 | | 文 獻 | |
| 純度 | 產率 | 活力 | ||||||
| 白血球 | 淋巴細胞(a) 單核細胞(b) | BSA(1.5~6.5%) | 9 分/20× g | 特制離心室 | a) > 90% b) ~ 90 % | a)90% b)67% | 99% | 5 |
| 白血球 | 淋巴細胞(a) 單核細胞(b) | Ficoll(2~4%) | 2 小時/1g | 重力沉 降室 | a) - b)69 ~ 77% | a) - b) 28% | >98 % | 12 |
| 白血球 | 淋巴細胞(a) 單核細胞(b) | Ficoll ( 3.4 ~ 16.9%) | 45 分/800 ×g | 低速區帶轉頭 | / | / | / | 12 |
| 預處理白血球 | 淋巴細胞(a) 嗜堿性細胞(b) | Ficoll(4.5~9.5 %) | 15 分/85 ×g | 甩平轉頭100ml 離心管 | a) > 95% b)62 ~ 72% | a) > 90% b)30 ~ 50% | / | 11 |
| 人骨髓細胞 | CFU-C | Ficoll(2~4%) | 2h/1g | 重力沉降室 | / | / | / | / |
| 預處理的犬胃 細胞 | 壁細胞(a) 主細胞(b) | Ficoll(2~4%) | 50 分/1g | 重力沉 降室 | a) > 60% b) 85% | a) ~ 50% b) ~ 30% | / | 12 |
| 竇狀肝細胞 | Kupffer(a) Endothelial(b) | Percoll (3.5~18%) | 8 分/16g | 特殊沉降室 | a) 98% b) 97% | a) 68% b) 86% | >95 % | 5 |
| | ||||||||
(四)細胞的離心浮選:
利用離心浮選法分離細胞zui初是在1948 年由Lindahl 提出的,當時取名為“逆流離心” (文獻12)。這個設想在上世紀60 年代中期由Beckman 公司研發成為商用浮選轉頭和浮選離心系統,經過逐步改進發展成目前的JE-6B(5ml,3,470×g)及JE-5.0(40ML,4,700×g) 和Hitachi 的R5E(40ml,5,000rpm )細胞浮選系統。現代的浮選分離可以用光學系統直接在TV 顯示屏上觀察離心浮選過程(透明錐形離心室)。
離心浮選法特點:
l 利用細胞懸浮在錐形離心室內受到的離心力,流體阻力和浮力的平衡關系實現不同
種類細胞的純化,純度很高。
l 不需要密度梯度;
l 適合分離純化直徑在5~50μm 的細胞;
l 收集細胞的數量可達107 ~1012 個(JE-5.0 或R5E);
l 通過光學系統可以觀測浮選過程;
l 可以實現自動收集已純化的細胞;
l R5E在離心機門上有照相機,記錄浮選過程;
l 離心浮選室可以高溫消毒(121℃,20分)
離心浮選系統組成:
l Hitachi或Beckman高速冷凍離心機;
l 離心浮選轉頭(日立R5E或貝克曼JE-5.0);
l 環氧樹脂透明離心室;
l 帶流量計、蠕動泵及加樣分配閥的加樣系統;
l 浮選轉頭觀察門蓋;
l 可以實現自動收集已純化的細胞;
l 光源組件(裝在轉頭下方);
l TV顯示系統.
例6 肝主質細胞倍體級分離(文獻13)
l 所需設備同上述。
l 干細胞浮選用介質:L-glutamine(131mg/l),L-aspartic acid(13.3mg/l),
L-threonine(23.8mg/l), L-serine(31.5mg/l), glycine(37.6mg/l), L-alanine(53.5mg/l),
L-glutamic acid(132.4mg/l), KCL(223.7mg/l), NaH2PO4·H2O(96.6mg/l),MgCl2·6H2O
(101.7mg/l), NaHCO3(2.01g/l), glucose(3.60g/l), fructose(3.60g/l),
Sucrose(67.4mg/l).溶液調節到PH7.4,滲透壓:308mOsm,配置后儲存在-20℃待用。
l 肝主質細胞懸液,從三月齡雌性WAG/Rij 鼠取出;
l trypan 藍染色劑。
l 結果:各種倍體細胞分布
| 二倍體(2n) | 四倍體(4n) | 八倍體(8n) | 16 倍體(16n) | |||
| 單核 | 雙核 | 單核 | 雙核 | 單核 | 雙核 | / |
| 9% | 16% | 53% | 16% | 4% | 2% | |
例7 鼠肝主質細胞的多倍體級浮選分離
l 設備及樣品:同例(5)
l 轉速1350rpm(~210g)
l 溫度4℃
l 初始充樣流速12ml/min,直至細胞充滿離心室
l 分別用流速19,32,41(ml/min)收集I,II,III 細胞,收集量分別為100ml,150ml 及100ml
l 已收集細胞儲存于4℃
l 停止輸液后轉頭停轉,從離心室收集沉淀并收集混合室樣品
l 用低速低溫離心機甩平轉頭分別將收集液離心沉淀,1000×g,10 分鐘,將沉淀與3ml 浮選介質混合制成倍體細胞懸液,4℃保存。
l 結果:細胞數量與活性分析
| 成分 | 流量ml/min | 細胞數量×106 | 活性(%) | 組成 |
| 原液 | | 137.8 | 84 | 2n,4n,8n,16n 及少量細胞聚集團及細胞碎片 |
| I | 19 | 39.8 | 72 | 2n,4n, 少量細胞碎片 |
| II | 32 | 54.7 | 85 | 4n(90%) |
| III | 41 | 15.5 | 83 | 4n,8n,細胞聚集團 |
| 沉淀 | | 17.1 | 82 | 同原液數據 |
| 混合室 | | 5.2 | 85 | 同原液數據 |
| 總數 | | 127.0(92%) | | |
例8 肝的Kupffer (星形細胞)及endothelial( 內皮)細胞純化
l 浮選設備:同上述例
l 浮選用介質:GBSS
l 各種染色介質(參考各節)
l 肝竇狀細胞(Sinusoidal)懸液
l 分離步驟
| i. | 用不連續Nycodenz 梯度制備鼠肝Sinusoidal 細胞懸液(參見本文前例) |
| ii. | 安裝離心浮選系統(Hitachi 或Beckman) |
| iii. | 標準離心室:3,250rpm,4℃ |
| iv. | 初始流量13.5ml/min 注入1~5×108個細胞懸液 |
| v. | 在流量分別為18,32,48ml/min 時分別收集100ml,150ml,150ml |
| | 收集液中含有白細胞(L)、星形細胞(K)、內皮細胞(E)及主質細胞(P),收集 |
| | 液保存在4℃。 |
| vi. | 離心后收集在浮選室中的細胞 |
| vii. | 各種收集液離心沉淀:450g×10 分,沉淀分別混懸于3mlGBSS 中 |
viii. 結果如下表:
| 成份 | 細胞主要類型 | 細胞總量×106 | 活性 | 染色細胞比例% | 組成% | | |||
| | | | % | P1 | E1 | P | L | E | K |
| 初始細胞液 | Sinusoidal | 167.4 | 87 | 24.7 | 86.8 | 0.6 | 13.2 | 61.5 | 24.7 |
| I 收集液(100ml) | L | 19.9 | 80 | 3.0 | 28.6 | / | 71.4 | 25.6 | 3 |
| II 收集液(150ml) | E | 82.5 | 95 | 9.0 | 89.2 | / | 10.8 | 80.2 | 9 |
| III 收集液(150ml) | K | 34.7 | 97 | 83.5 | 95.1 | / | 4.9 | 11.6 | 83.5 |
| 沉淀 | 細胞聚集團 | 9.8 | 95 | 34.5 | 96 | 16.0 | 4.0 | 44.6 | 35.4 |
注:
l 表成染色比例中 P1:Peroxidase 過氧化物,E1:Esterrase(酯酶)
l Sinusoidal 細胞制備方法參見前述內容。
例9 鼠肝儲脂細胞的離心浮選純化(文獻14)
| i. | 離心浮選設備(同上) |
| ii. | 轉速3,250rpm,4℃,流量16ml/min |
| iii. | Sinusoidal 細胞制備參照前述二階不連續梯度離心法。 |
| iv. | 加樣:5~50×107 個細胞注入混合室 |
| v. | 用16ml/min 及18ml/min 分別收集二次,zui后收集在離心室中剩下的細胞液 |
| vi. | 以上三種收集液分別450g×10 分鐘離心,收集沉淀后分別用2mlGBSS 混成 |
| | 懸液 |
結果如下表:
| 成份 | 細胞主要類型 | 細胞總量×106 | 活性% | 染色細胞比例% | | 組成% | | ||
| | | | | P | E1 | F | L | E | K |
| 初始樣品 | E.F | 133 | 94 | 8 | 98 | 16 | 2 | 75 | 8 |
| F1 | F | 14 | 80 | 1 | 88 | 78 | 12 | 9 | / |
| F2 | F | 6 | 85 | 1 | 94 | 53 | 6 | 40 | / |
| 沉淀 | E | 108 | 93 | 1 | 99 | 7 | / | 81 | 11 |
注:①E:endothelal Cell ②初始樣品取12 月齡鼠肝,二步不連續梯度分離后取上層
F:Fat-storing Cell
P1:Peroxidase
E1:Esterrase
L:Lymphocytes
K:Kupffer
例10 用離心浮選法從人血中純化單核白細胞
l 離心浮選設備同上述
l 浮選前、后處理需要低速低溫離心機50ml 甩平轉頭
l 浮選用液:含25mM 葡萄糖及1%(W/V)BSA 的磷酸緩沖液
l 酯酶(Esterrase)染色所需設備及試劑
l 肝素化(利用肝素增加血液凝固時間)人血(50ml)
l 梯度材料Ficoll-Pague (Pharmacia-Biosystems)
Lymphoprep (Nycomed Pharma,A/S)
l 磷酸鹽緩沖液(PBS)(50mM,PH7.4)
分離步驟:
| i. | 用例(1) 的方法從50ml 血樣中純化單核細胞,從分界面收獲細胞液, 加浮選 |
| | 液后容積為5ml 。 |
| ii. | 安裝離心浮選系統,用浮選液充滿浮選離心室,設置5℃。 |
| iii. | 預置轉速2,030rpm, 設定流量4.7ml/min |
| iv. | 加入樣品(1×108 個細胞), 離心,分九次收集,每次50ml 分別用流量4.7,8.0, |
| | 10.0,11.0,12.0,12.7,13.5,14.5,16ml/min 收集。 |
| v. | 收集后的細胞樣品分別用450g×10 分收集沉淀。 |
| vi. | 將以上沉淀分別用3ml 浮選液稀釋成懸液 |
| vii. | Esterrase 染色后計數 |
| | 結果如下表: |
| 成份 | 流量(ml/min) | 細胞數量(×106) | 酯酶染色 | |
| 負染(%) | 正染(%) | |||
| 原液 | / | 104 | 85.6 | 14.4 |
| 1 | 4.7 | 0 | / | / |
| 2 | 8.0 | 3 | 100 | 0 |
| 3 | 10.0 | 17.8 | 99.7 | 0.3 |
| 4 | 11.0 | 25.0 | 99.3 | 0.7 |
| 5 | 12.0 | 25.0 | 98.0 | 2.0 |
| 6 | 12.7 | 10.8 | 95.2 | 4.8 |
| 7 | 13.5 | 1.2 | 95.3 | 4.7 |
| 8 | 14.5 | 0.8 | 84.5 | 15.5 |
| 9 | 16 | 2.0 | 58.7 | 41.3 |
| 沉淀 | / | 10.0 | 28.4 | 71.6 |
參考文獻:
1 :“Bruwer,A“等“Centrifugal Separations of mammalian calls”in“Centrifugation-a Practical
approach”PP271~314 OXFORD Uni.press,1992.
2:“B∮yun , A.”“Scand. J. Clin. Inrest. Vol. 21 (Suppl. 97) P. 77”
3:Wisse,E.等“Progress in liver diseases”Vol:Ⅵ P153,Grune and Stratton,Inc.1979)
4:“B∮yun , A. 等” “Iodinated density gradient media:a practical approach, Oxford Uni.IRL Press 1984
5:Tulp.A. 等 Anal.Biochem.Vol.117 P354 (1981)
6:Brouwer,A 等人“Sinusoidal liver cells” P509,Elsevier Biomedical press .Amsterdam, 1982
7:Pertoft, H 等“Cell Separation:methods and selected applications”Vol 1,P41 Academic press. New York 1982
approach”PP271~314 OXFORD Uni.press,1992.
2:“B∮yun , A.”“Scand. J. Clin. Inrest. Vol. 21 (Suppl. 97) P. 77”
3:Wisse,E.等“Progress in liver diseases”Vol:Ⅵ P153,Grune and Stratton,Inc.1979)
4:“B∮yun , A. 等” “Iodinated density gradient media:a practical approach, Oxford Uni.IRL Press 1984
5:Tulp.A. 等 Anal.Biochem.Vol.117 P354 (1981)
6:Brouwer,A 等人“Sinusoidal liver cells” P509,Elsevier Biomedical press .Amsterdam, 1982
7:Pertoft, H 等“Cell Separation:methods and selected applications”Vol 1,P41 Academic press. New York 1982
8:Remenyik,C.J. 等Arch. Biochem. Biophys.Vol:201 P500
9:B∮yun , A.“Scand .J.Clin.Invest.Vd:21, P77
10:Knook, D. L. 等“Exp. Cell Res. Vol:99, P444
11:MacGlashan, D.W 等“Cell Separation:Methods and Selected application ”Vol:1 P301 Academic Press. New York 1982
12:Wells, J.R. 同上書P169
13:Bezooijen C.F.A 等“Pharmacological morphological and Phisiological Aspects of liver aging” Vol:1 P115(1984)
14:Knock,D,L 等“Exp 。Cell Res. Vol:139 P468 (1982)
上資料由http://www.xiangzhilxj.com/ 長沙湘智離心機儀器有限公司轉載提供,供您學習參考!長沙湘智離心機儀器有限公司是專業生產制造離心機、實驗室儀器的高科技企業。公司擁有一批經驗豐富的工程技術人員,專業從事實驗室儀器的設計、開發和生產。公司生產、技術骨干均是多年從事實驗儀器的精英。公司生產高速冷凍離心機冷凍離心機;大容量離心機;高速離心機;低速離心機、脫帽離心機等產品品種齊全,全系列離心機實現無刷化,技術先進、性能穩定、質量可靠。歡迎垂詢!地 址:湖南省長沙市岳麓區湘儀路竹馬巷37號 : 410205 ;
電 話::李 1391780350網 址:www.xiangzhilxj.com
免責聲明
- 凡本網注明“來源:化工儀器網”的所有作品,均為浙江興旺寶明通網絡有限公司-化工儀器網合法擁有版權或有權使用的作品,未經本網授權不得轉載、摘編或利用其它方式使用上述作品。已經本網授權使用作品的,應在授權范圍內使用,并注明“來源:化工儀器網”。違反上述聲明者,本網將追究其相關法律責任。
- 本網轉載并注明自其他來源(非化工儀器網)的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品第一來源,并自負版權等法律責任。
- 如涉及作品內容、版權等問題,請在作品發表之日起一周內與本網聯系,否則視為放棄相關權利。
 手機版
手機版 化工儀器網手機版
化工儀器網手機版
 化工儀器網小程序
化工儀器網小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關注視頻號
掃碼關注視頻號


















 采購中心
采購中心