技術文章
研究揭示TET同源蛋白催化DNA中5mC形成
閱讀:358 發布時間:2021-3-312月2日,中國科學院分子細胞科學創新中心(生物化學與細胞生物學研究所)研究員丁建平研究組在Nature Communications上發表題為Molecular mechanism for vitamin C-derived C5-glyceryl-methylcytosine DNA modification catalyzed by algal TET homologue CMD1的論文,該研究揭示了衣藻中TET同源蛋白CMD1以維生素C作為共底物(co-substrate),催化DNA中5mC修飾形成5gmC修飾的分子機制。
近年來,表觀遺傳學研究領域致力于發現新型DNA修飾方式。研究表明,TET蛋白利用Fe2+和2-酮戊二酸(2-oxogluatarate, 2-OG)能夠催化5mC發生多步氧化反應,依次形成5hmC、5fC以及5caC。2019年,中國科學院院士徐國良等多個課題組合作研究發現,萊茵衣藻(Chlamydomonas reinhardtii)中TET同源蛋白CMD1(5-methylcytosine modifying enzyme 1)能夠以維生素C(vitamin C, VC)為共反應底物,催化DNA的5mC產生一種全新的DNA修飾5gmC(5-glyceryl-methylcytosine),并在萊茵衣藻的光合作用中發揮重要調節作用。CMD1作為2-OG依賴的雙加氧酶家族成員,催化5mC形成5gmC需要VC而非2-OG,這與該家族其他成員顯著不同。在CMD1被報道之前,VC主要作為抗氧化劑發揮功能,或作為還原劑促進2-OG依賴的雙加氧酶的催化活性,未有研究表明VC能夠作為共反應底物發揮生物學功能。CMD1如何利用VC而非2-OG催化5mC發生修飾,以及CMD1是否具有底物特異性等科學問題及其分子機制尚不清楚。
丁建平研究組助理研究員李文婧、研究員張天龍和博士研究生孫明亮合作對CMD1的結構、功能和分子機制開展了深入研究。通過生化分析發現,CMD1對不同長度、結構及5mC修飾水平的DNA底物具有相近的親和力,但對含有5mCpG的DNA有一定程度的底物偏好性。此外,科研人員解析了CMD1原酶、結合VC、結合DNA或5mC-DNA、以及結合5mC-DNA和VC的復合物的高分辨率晶體結構。結構分析表明,CMD1的整體結構采用典型的2-OG依賴的雙加氧酶家族的DSBH(double-stranded β-helix)折疊方式。在CMD1結合VC以及結合5mC-DNA和VC的復合物結構中,VC均以內酯形式存在。相互作用分析表明,VC通過廣泛的氫鍵和疏水相互作用結合在CMD1的活性位點,并通過單配位與Fe2+螯合,這與其他2-OG依賴的雙加氧酶中2-OG以雙配位與Fe2+螯合的方式不同。體外酶活實驗表明,CMD1催化的反應只有當VC以內酯形式存在時才能發生。CMD1-VC-5mC-DNA三元復合物的結構代表了CMD1催化反應的起始狀態,在該結構中DNA底物主要通過磷酸骨架與CMD1正電荷富集的表面相互作用,DNA底物鏈中的5mC從雙鏈DNA中翻轉出來并插入CMD1的活性位點;5mC的甲基基團指向VC,但沒有被特異性識別,因此未修飾的C也能夠插入CMD1的活性位點。突變體實驗表明,CMD1的催化活性依賴于金屬離子、VC和DNA底物的正確結合。與TET蛋白的結構比較闡明了CMD1和TET蛋白使用不同共反應底物催化反應的結構基礎,但CMD1和TET蛋白對底物5mC的結合和識別方式卻十分相似。上述研究結果揭示了CMD1以VC為共底物,催化DNA中5mC修飾形成5gmC修飾的分子機制。
分子細胞中心徐國良研究組參與了該項研究。研究工作得到上海同步輻射光源BL17U1線站和國家蛋白質科學研究設施(上海)BL18U和BL19U1線站、分子細胞中心分子平臺的支持,以及中科院戰略性先導科技專項(B類)和科學技術部國家重點研發計劃的支持。
論文鏈接
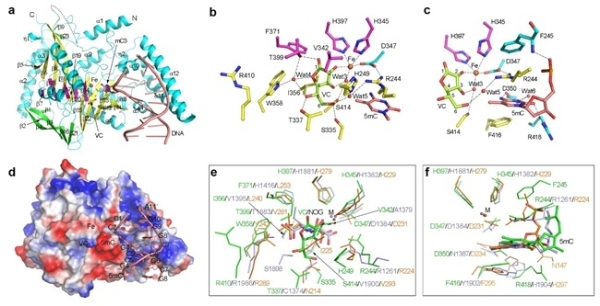
(a) CMD1-VC-5mC-DNA三元復合物的整體結構。(b, c) CMD1的活性位點。(d) CMD1的表面電勢分布以及與5mc-DNA的結合方式。(e, f) CMD1與TET蛋白活性位點的結構比較(綠色:CMD1;淺藍色:HsTET2;橙色:NgTET1)。
 化工儀器網
化工儀器網