技術文章
NLRP3和pyrin炎性體的MTOC定位所發揮的雙重激活和抑制作用
閱讀:780 發布時間:2020-9-30典型炎性體是一種多組分蛋白復合物,通過活化caspase-1,在對感染和危險的免疫監控中發揮關鍵作用。活化的caspase-1裂解白細胞介素1(IL-1)和成孔蛋白gasdermin D,從而導致細胞因子成熟和細胞焦亡。核苷酸結合結構域、富含亮氨酸的重復序列和含熱蛋白(pyrin)結構域的蛋白3(NLRP3)可被尼日利亞菌素nigericin)、細胞外ATP和尿酸單鈉(MSU)晶體、明礬、二氧化硅和淀粉樣蛋白等各種微粒激活,而pyrin炎性體可被艱難梭菌毒素B的Rho-葡糖基化活性所刺激。炎性體激活的一個重要特征是每個細胞形成單個超分子點狀物(也稱為斑點)。然而,這類點狀物的位置和轉運仍然是未知的。
在一項新的研究中,為了破解巨噬細胞中炎性體組裝和激活的部位和分子機制,來自美國哈佛醫學院、波士頓兒童醫院、密歇根大學、馬薩諸塞大學、中國中南大學、挪威科技大學和德國波恩大學的研究人員通過細胞成像,輔以細胞和小鼠中的藥物抑制和靶向剔除,可視化觀察炎性體組裝。
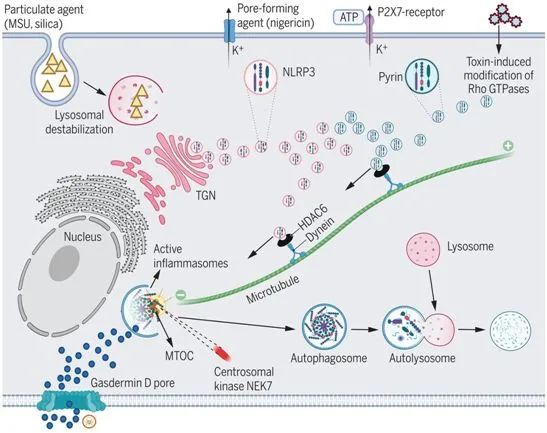
這些研究人員發現NLRP3和pyrin炎性體在每個細胞的中心體中組裝,中心體也被稱為微管組織中心(MTOC),是caspase-1活化和IL-1β轉化的主要場所。微管聚合、動力蛋白ATP酶和動力蛋白銜接蛋白---組蛋白去乙酰化酶6(HDAC6)---的藥理學抑制劑,以及Hdac6的靶向剔除或敲降,都會損害這些炎性體的組裝和激活。對Hdac6-/-巨噬細胞的重建表明HDAC6的泛素結合能力,而不是它的去乙酰化酶活性,是NLRP3和pyrin炎性體激活所必需的。
在小鼠中,Hdac6的缺失可減少脂多糖和尿酸單鈉誘導的炎癥,其程度與直接抑制NLRP3相似,這表明HDAC6和微管逆向運輸機制是NLRP3激活所必需的。相比之下,AIM2和NLRC4炎性體點狀物并不定位在MTOC中,這些炎性體的激活不需要微管逆向運輸。因此,這項研究揭示了NLRP3和pyrin炎性體的特異性激活機制。
對于NLRP3炎性體而言,MTOC定位可能促進與定位于中心體的激酶NEK7的結合,從而增強炎性體組裝。這些研究人員發現在Hdac6-/-巨噬細胞中,NLRP3在反面高爾基體網絡(trans-Golgi network, TGN)中以小斑點的形式被捕獲,TGN是以前*的經多種NLRP3刺激物誘導后的常見NLRP3結合部位。
這些數據表明,HDAC6介導的微管運輸將NLRP3從TGN輸送到MTOC。在MTOC形成的NLRP3炎性體與LC3b(一種自噬標志物物)共定位,而且自噬抑制劑可增強NLRP3誘導的IL-1β分泌。
總之,這項研究揭示了HDAC6依賴性的NLRP3和pyrin炎性體組裝與MTOC中的聚集體(aggresome)形成之間存在著意想不到的平行關系,所形成的聚集體可用于泛素化病理聚集物的自噬降解。NLRP3和pyrin炎性體的MTOC定位所發揮的雙重激活和抑制作用可能是實現炎性體平衡調節的關鍵。
 化工儀器網
化工儀器網